一、管理体系认证规则
|
认证规则编号 |
认证规则名称 |
|
职业健康安全管理体系认证实施方案 |
|
|
环境管理体系认证实施方案 |
|
|
建筑工程行业质量管理体系认证实施方案 |
|
|
医疗器械质量管理体系认证实施方案 |
以上认证规则归北京国医械华光认证有限公司所有,北京国医械华光认证有限公司对其拥有最终解释权。任何组织及个人未经北京国医械华光认证有限公司许可,不得以任何形式全部或部分使用(法律要求除外)认证相关信息。如需获取相关认证规则请与以下联系方式获取:
通讯地址:北京市东城区安定门外大街甲88号中联大厦第五层
电话:010-64237550
邮箱:cmd-qa1@cmdc.com.cn
网址:www.cmdc.com.cn
二、管理体系认证简介
|
管理体系认证须知 |
|
一、管理体系认证工作流程 二、管理体系认证注册条件 三、管理体系认证的认可业务范围 四、管理体系认证 注册申请材料 五、管理体系认证收费 六、管理体系认证注册的授予、保持、扩大、更新、缩小、暂停和撤销/注销管理质量管理体系认证工作流程 |
|
管理体系认证工作流程 |
|
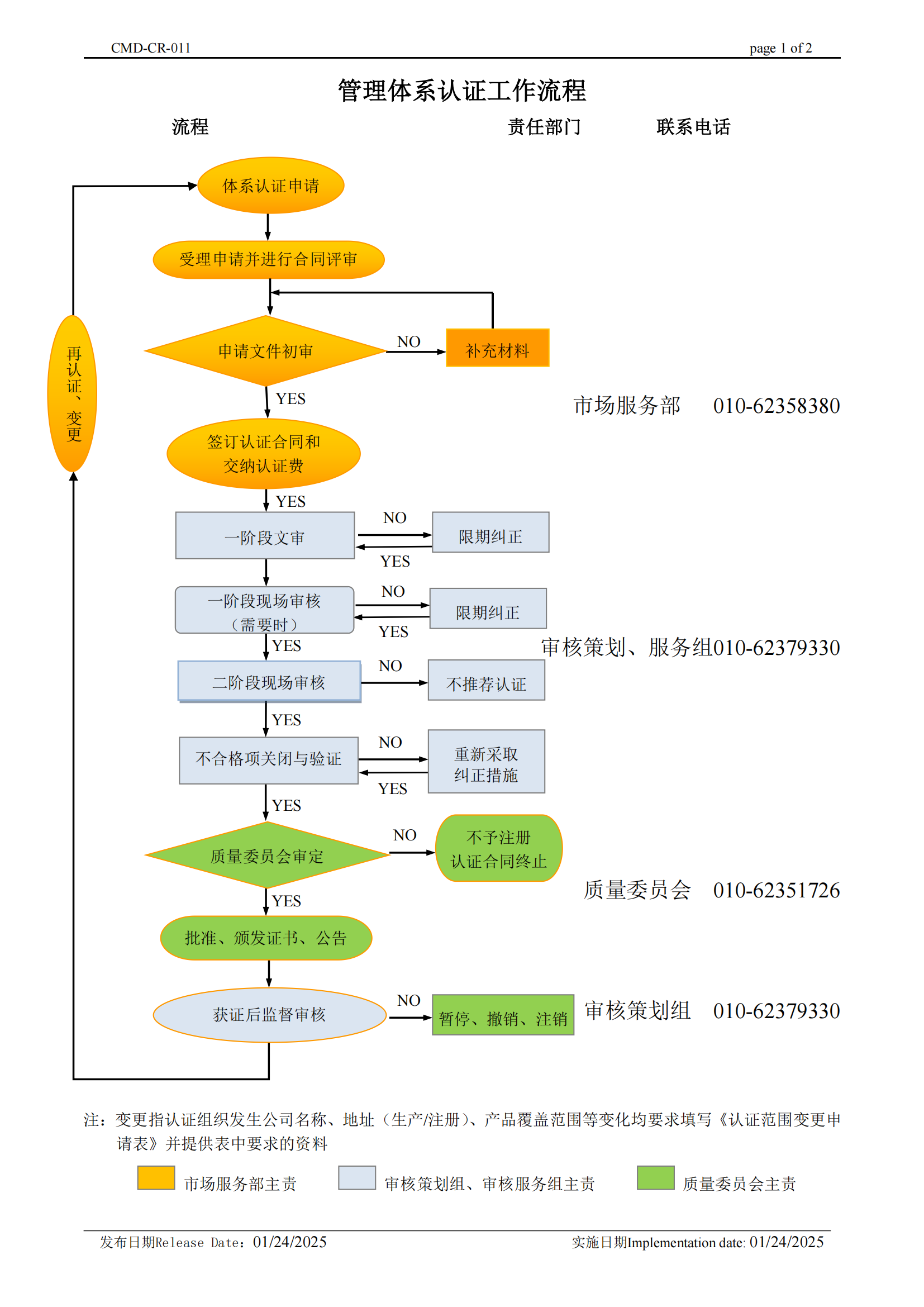
|
|
|
|
管理体系认证注册条件 |
|
1.申请组织应持有法人营业执照或证明其法律地位的文件。 2.已取得生产许可证或其它资质证明(国家或部门法规有要求时); 3.申请认证的管理体系覆盖的产品应符合有关国家标准、行业标准或注册产品标准(企业标准),产品定型且成批生产。
4.申请组织应建立符合拟申请认证标准的管理体系、对从事医疗器械生产、经营企业还应符合YY/T 0287标准的要求,生产三类医疗器械的企业,管理体系运行时间不少于6个月, 其它类型的组织,管理体系运行时间不少于3个月。 5.申请组织至少进行过一次全面内部审核及一次管理评审。 6.在提出认证申请前的一年内,申请组织的产品无重大顾客投诉及质量事故。 |
|
|
|
管理体系认证注册申请材料要求 |
|
1.申请组织授权代表签署的管理体系认证申请书; 2.申请组织营业执照(复印件); 3.其它资质证明(国家或部门法规有要求时);如,属于3C认证的产品,还应提供3C认证证书(复印件); 4.质量手册及程序文件清单,必要时提供程序文件; 5.非医疗器械类制造商还应提供产品适用的法规清单; 6.对于体系覆盖的产品仅提供出口的应提供出口国适用的法规清单,还须提供出口证明文件; 7.管理评审报告、内审报告; 8.产品生产流程及特殊过程、关键过程说明; 9.产品或服务涉及的强制性标准/要求、企业标准清单; 10.产品技术报告或说明书; 11.对于医疗器械生产企业应同时提交“医疗器械企业生产许可证”,已经取得医疗器械产品注册的产品提交“医疗器械产品注册证”(复印件)(包括医疗器械注册登记表); 12.未取得医疗器械产品注册证的医疗器械产品应提交以下材料: a)产品标准及说明 ; b)产品注册检测报告; c)符合相应规定的临床试验资料或豁免临床的说明; d)产品说明书; e)二、三类医疗器械产品提交产品技术报告和风险管理报告; 注:如同时申请医疗器械产品认证,相同材料可只提交一份。 |
|
|
|
管理体系认证收费 |
|
见公开文件 CMD-CR-010认证收费标准及审核人日Certification Charge standard and audit days20250124_6C7dPB.pdf |
|
管理体系认证的授予、保持、扩大、更新、缩小、暂停和撤销/注销管理 |
|
1目的 本文件规定了北京国医械华光认证有限公司在进行管理体系认证活动中,对于管理体系认证的授予、保持、扩大、更新、缩小、暂停和撤销/注销的管理。 2管理体系认证注册的授予或更新(再认证) -通过现场审核证实申请认证组织按标准要求建立的管理体系符合认证准则的要求,并且能够得到有效实施和保持; -审核过程符合管理体系认证程序要求,现场审核开具的不符合全部得到有效的关闭; -产品实物质量符合规定要求; -符合有关法律法规要求。 注:获证组织应在认证有效期(三年)满前四个月提出再认证申请。 3管理体系认证注册的保持 -通过监督审核证实获证组织的管理体系持续符合认证准则的要求,并能有效运行,管理评审、内部审核和纠正和预防措施实施有效。 -监督审核过程符合管理体系认证程序的规定,现场审核开具的不符合全部得到有效的关闭,且上次审核的不符合项的纠正措施经验证有效; -认证证书和标志使用正确; -产品实物质量符合规定要求; -符合有关法律法规要求。 4管理体系认证范围的扩大 4.1获证组织可因以下原因以书面形式向CMD提出扩大管理体系认证范围的申请: a) 获证组织的管理体系发生了重大变化,如成立了分支机构并将其覆盖在管理体系认证范围内; b) 获证组织管理体系所覆盖的产品范围增加。 4.2当获证组织管理体系有上述情况变化时,应提前向CMD市场服务部提出扩大管理体系认证范围的申请并提交相应材料。 4.3CMD考虑认证范围扩大所涉及的场所、审核依据标准、过程、产品复杂程度等因素,确定变更认证范围的途径;如需现场审核则应明确扩大需要的审核时间,并与该获证组织补充签署认证协议。认证范围扩大的审核可与监督审核一起进行,也可单独进行。 5管理体系认证注册的暂停 5.1有下列情况之一的,CMD暂停获证组织质量管理体系认证资格: a) 不能在规定期限内接受CMD监督审核和再认证审核的; b) 获证组织未按期缴纳费用且经指出后未予纠正的; c) 获证组织主动请求暂停的; d) 在国家、省市产品监督抽查活动中获证组织不能保持产品实物质量符合规定要求且不能按规定期限采取有效措施的; e) 监督审核发现获证组织质量管理体系不符合认证要求,但严重程度尚不构成撤销质量管理体系认证资格; f)不能在规定期限内对CMD监督审核中提出的不符合项采取有效的纠正和纠正措施的; g) 顾客对获证组织质量管理体系覆盖的产品提出严重质量问题并经查实造成危害的; h) 获证组织对管理体系认证证书和认证标志的使用不符合CMD规定的; i)发现其它违反管理体系认证规则的情况。 5.2被暂停认证注册的组织在接到暂停通知后,应立即停止认证证书的使用。暂停信息将在CMD网站上予以公布。 5.3被暂停认证注册的组织在暂停期内使用证书造成任何后果,应全部由被暂停认证注册的组织负责。 5.4被暂停认证注册的组织应在暂停期限内解决造成暂停问题,并在暂停期满前提出恢复认证资格的申请。一般情况下,应安排一次现场审核后,CMD再做出是否能够恢复认证资格的决定。 6管理体系认证注册的撤销或缩小 6.1有下列情况之一的,CMD应撤销获证组织使用管理体系认证注册资格或缩小认证范围: a) 未能在CMD规定时限内解决造成暂停的问题; b) 获证组织管理体系覆盖的产品质量有严重问题并且造成严重后果的; c) 监督审核发现获证组织质量管理体系存在严重不符合规定要求的情况; d) 认证范围不能持续满足认证要求,如:覆盖的产品已不继续生产或已属淘汰产品、资源等条件发生变化,原认证范围已不能维持; e) 严重违反认证要求的情况(如:转让管理体系认证文件); f) 发现CMD与获证组织之间正式协议中规定要求的其它构成撤销管理体系认证资格情况。 6.2认证范围的缩小应与认证标准的要求一致。若由于缩小而导致不能符合认证标准要求的,应做撤消处理。CMD将对是否需要全部撤消或缩小认证范围做出决定。 6.3被撤销认证注册的组织应交回所有认证文件;对于缩小认证范围的需变更证书。撤销或缩小信息将在CMD网站上予以公布。 6.4被撤消认证注册的组织不得继续使用认证证书或进行有关宣传,若继续使用认证证书或进行有关宣传而造成的任何后果,应全部由被撤消认证注册的组织负责。 6.5原则上,被撤销管理体系认证资格的组织一年后方可重新提出管理体系认证申请。 7管理体系认证注册的注销 7.1认证注销是指获证组织由于某种原因主动提出不继续保持管理体系认证注册的资格。 7.2注销认证注册的组织应交回所有认证文件。注销信息将在CMD网站上予以公布。 7.3已注销认证注册的组织不得继续使用认证证书或进行有关宣传,若继续使用认证证书或进行有关宣传而造成的任何后果,应全部由已注销认证注册的组织负责。 |

